研究揭示辅助分子伴侣Cpn11/20/23调控叶绿体ClpP蛋白酶复合体的分子机制
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)丛尧研究组与中科院遗传与发育研究所刘翠敏研究组合作 , 在Nature Plants上 , 在线发表了研究论文The cryo-EM structure of the chloroplast ClpP complex 。该研究首次解析了莱茵衣藻叶绿体ClpP蛋白酶复合体及其结合辅助分子伴侣Cpn11/20/23的高分辨率冷冻电镜结构 , 鉴定了ClpP复合体的亚基组成与排布 , 揭示了辅助分子伴侣Cpn11/20/23调节ClpP蛋白酶水解活性的分子机制 。
植物叶绿体内的大部分蛋白质直接或间接参与光合作用 。蛋白质稳态主要由负责蛋白质折叠的分子伴侣以及负责蛋白质降解的蛋白酶体调控 。科研团队先前发现 , 叶绿体辅助分子伴侣Cpn20与分子伴侣素Cpn60相互作用协助蛋白质折叠 , 同时 , Cpn20与ClpP蛋白酶相互作用减慢ClpP降解底物的速度 。
研究通过亲合标签在莱茵衣藻(Chlamydomonas reinhardtii)叶绿体内纯化了完整的ClpP蛋白酶复合体 。质谱及免疫印迹结果表明 , 纯化的蛋白中含有一定量的辅助分子伴侣Cpn11/20/23 。体外生化实验证明辅助分子伴侣Cpn11/20/23与ClpP存在相互作用 , 并抑制ClpP蛋白酶的底物降解活性 。在此基础上 , 科研团队首次解析了ClpP复合体以及ClpP-Cpn11/20/23复合体的高分辨率冷冻电镜结构 , 并进一步确定了ClpP及Cpn11/20/23各亚基的排布以及两者相互作用的网络和机制(图A、B) 。研究显示 , Cpn11/20/23结合于ClpP的底物运输通道顶部 , 抑制了ClpP的蛋白酶活性 。Cpn11/20/23利用相同的环结构 , 分别与分子伴侣素Cpn60及ClpP蛋白酶相互作用 , 这表明其在叶绿体内重要的调控作用(图C、D) 。
该研究首次阐明了真核细胞叶绿体中ClpP复合体的三维结构和催化机理 , 发现了辅助分子伴侣Cpn11/20/23的全新生化功能 , 这为剖析分子伴侣素与蛋白酶相互配合共同调节叶绿体内蛋白质稳态提供了新的科学视角 。
研究工作得到国家自然科学基金委员会、科学技术部、中科院和上海市科学技术委员会等的资助 , 并获得国家蛋白质科学研究(上海)设施冷冻电镜系统、数据库与计算分析系统及质谱系统的支持 。
【研究揭示辅助分子伴侣Cpn11/20/23调控叶绿体ClpP蛋白酶复合体的分子机制】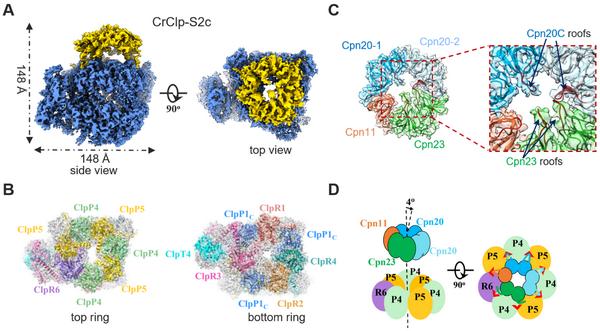
文章图片
文章图片
A、莱茵衣藻叶绿体ClpP-Cpn11/20/23复合体的冷冻电镜结构 , 蓝色为Clp蛋白酶复合体结构 , 顶部金色的“帽子”结构是辅助分子伴侣Cpn11/20/23;B、ClpP复合体的亚基排布示意图;C、辅助分子伴侣Cpn11/20/23的亚基排布示意图;D、辅助分子伴侣Cpn11/20/23调控ClpP复合体的分子机制示意图
来源:中国科学院分子细胞科学卓越创新中心
来源:中科院之声
推荐阅读
- 王者荣耀官宣4个婚纱皮肤英雄,3个法师英雄,一个辅助英雄
- 王者荣耀:又一t0辅助诞生,坦度比肩张飞,控制不输墨子
- BLG发文祝贺辅助选手Crisp刘青松LPL登场五周年
- FPX真试训了7个辅助!宝蓝透露自己是其中之一
- uzi:随便找个辅助都能赢,这个分段真的不行
- ig冠军选手被退货?宝蓝:fpx试训了7个辅助
- iwandy韩服改名,iwandy不满tes让双辅助竞争上岗
- 王者荣耀:一技能可以击杀龙王的3位辅助!低端局没有人用
- 大熊猫为啥吃竹子也能当胖子?研究发现“催肥”肠道菌
- 王者荣耀高端局最需要的3个辅助,随便练会一个,段位最少30星













