肿瘤精准治疗的挑战与未来( 四 )
文章图片
文章图片
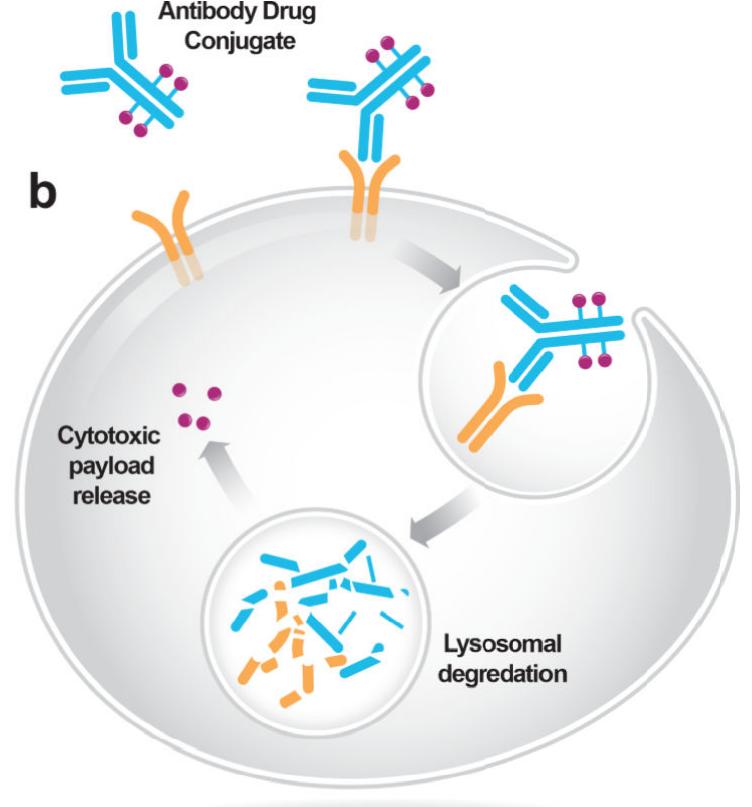
目前 , 已有多个此类药物开始在临床上得到应用 。例如 , ADC药物trastuzumab deruxtecan( DS8201 )是由与细胞毒性拓扑异构酶I抑制剂deruxtecan偶联到抗HER2抗体曲妥珠单抗组成 。这种药物在HER2驱动的癌症中表现出前所未有的活性 , 包括HER2+的乳腺癌和胃癌 , 以及在HER2低表达的乳腺癌中也具有很好的活性 , 而在这类病人 ,HER2靶向治疗在很大程度上往往是无效的 。确定适合ADC开发的肿瘤特异性靶点并优化这些工程药物的安全性将是其进一步开发和利用的关键 。
变构抑制剂
传统上 , 大多数小分子抑制剂都以ATP结合位点为靶点 。最近 , 基于结构的药物设计、具有动态模拟的计算化学以及高通量药物筛选方法的进展共同促成了非ATP竞争性抑制剂的开发 , 这些抑制剂结合了新的变构位点 。这些变构抑制剂可克服由已验证靶点活性位点突变介导的靶点耐药 , 并可抑制先前不可成药的蛋白 。例如 , 靶向BCR-ABL融合阳性的变构抑制剂asciminib( ABL001 )已经进入临床 , 并在已使用多种ATP竞争性抑制剂治疗的顽固性耐药AML患者中证明了药效 。另一个正在积极探索的方法是将选择性ATP竞争性抑制剂和变构抑制剂联合应用 , 这可能共同延缓甚至完全阻止获得性耐药性的发展 。变构抑制剂也可以使治疗针对以前无法靶向的目标 。例如 , 磷酸酶SHP2与SOS1一起在促成核苷酸交换方面发挥重要作用 , 使RAS在其非活性GDP结合态和激活GTP结合态之间循环 。磷酸酶以前被认为是不具吸引力的药物靶点 , 但变构抑制剂可以改变SHP2的构象并消除其活性 , 这在临床前动物模型中已证明了药效 , 目前 , 一些临床试验正在进行中 。
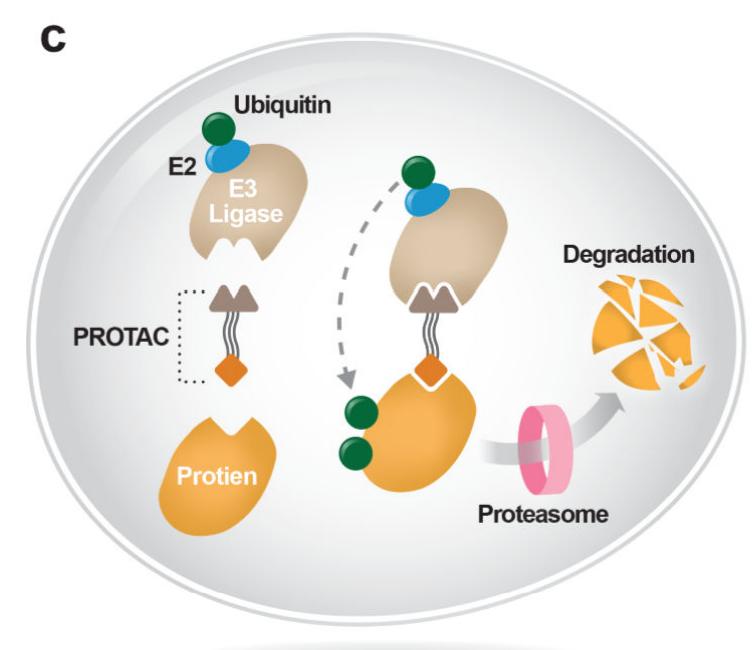
蛋白水解靶向嵌合体(PROTA)另一种新出现的靶向关键癌症驱动因子的方法是PROTACS , 这种方法通常使用双功能分子 , 使目标蛋白接近泛素连接酶 , 最终导致目标蛋白降解 。
文章图片
文章图片
这项技术在癌症治疗中的应用还处于起步阶段 , 与关键癌基因的变构抑制剂一样 , 这种技术可能会克服由已验证靶点活性位点突变介导的靶点耐药 , 并可抑制先前不可成药的蛋白 。许多癌症的关键驱动因素 , 包括转录因子 , 都不能被目前可用的治疗方法靶向 , 要么是因为它们不在细胞表面表达 , 因此抗体无法接近 , 要么是因为它们缺乏小分子抑制剂可以附着的结合囊 。PROTACs可以克服这些挑战 , 通过同时结合靶点和E3泛素连接酶来利用细胞的内源性蛋白质降解机制 , 促进蛋白质降解 。ARV-110是第一个进入I期临床试验的药物 , 它将前列腺癌患者的E3泛素连接酶与雄激素受体联系起来( NCT03888612 ) 。这种降低细胞蛋白水平的新方法可以有效地靶向许多以前不可治疗的靶点 。
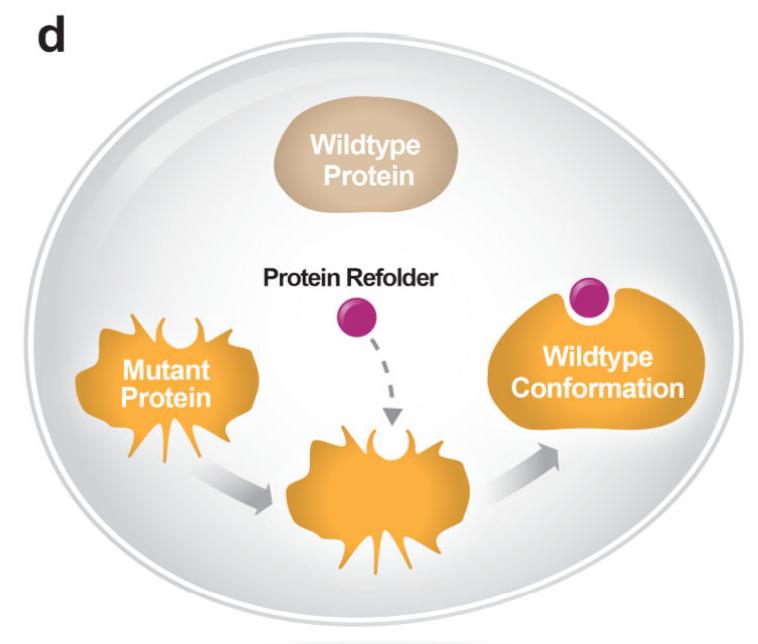
蛋白质复性通过塑造蛋白质构象来恢复突变蛋白质的自然功能 , 从而重新启用失去的活性 , 目前 , 这类小分子药物正在得到开发 。
文章图片
文章图片
这一策略已经在囊性纤维化的治疗中被证明是成功的 , 囊性纤维化是一种非肿瘤遗传性疾病 , 其特征是编码囊性纤维化跨膜传导调节蛋白( CFTR )的基因突变导致粘液分泌过多 。通过重新使CFTR到达细胞表面并发挥与野生型蛋白类似的功能 , 蛋白质复性药物减少了囊性纤维化的临床后遗症 。蛋白质复性在癌症中的应用目前正在探索中 , 它代表了靶向突变肿瘤抑制因子的一种新方法 。肿瘤抑制因子TP53的功能缺失突变是癌症中最常见的突变 。然而 , 目前还没有专门针对TP53突变癌症的治疗方法 , 通过蛋白质复性恢复突变体TP53活性的小分子正在研发中 。除了扩大可能的药物靶点的数量外 , 这种方法还提供了额外的益处 , 比如降低了毒性 。
推荐阅读
- 熬夜导致睡眠紊乱 去年6万余人找医生治疗失眠
- 青春不留痘!本周末,云大医院专家团齐聚痤疮治疗名医工作站会诊!
- 四川华美紫馨皮肤科院长李纯青受邀参会,解读《微针治疗操作规范》
- 「公益征集」银屑病(牛皮癣)患者100名,在线申请精准检查援助
- 货车司机突发罕见感染重症深圳平乐医院中西医协同治疗成功救治
- 日企粒子线癌症治疗系统:癌细胞杀伤力倍增
- 5天完成门诊血液透析室扩容 交大一附院承担高新区部分透析病人治疗
- 精准诊断,济医附院开展两例心脏活检术
- 新冠概念股远大医药治疗重症新冠临床研究获重要进展
- 延缓衰老、改善生长发育、抑制肿瘤......7项保健食品功能拟取消













