CAR-T疗法迎来收获期,如何突破安全性瓶颈?( 二 )
2.2 利用雷帕霉素诱导FKBP12和FRB结合域的组装来控制CAR-T细胞的激活
CAR-T细胞具有细胞外抗原识别域和细胞内信号域 。设计基于小分子开关的另一种策略是在小分子药物存在的情况下拆分这两种结构并重新连接它们 。
雷帕霉素和雷帕霉素类似物(rapalogues)可用作二聚化化学诱导剂(CID)来组装引入CAR结构的结构域 。雷帕霉素同时占据两种蛋白质的两个不同的疏水结合口袋:人FK506结合蛋白(FKBP12)和FKBP-雷帕霉素相关蛋白(FRAP)的FKBP12-雷帕霉素结合(FRB)域 。因此 , 将FKBP12-雷帕霉素-FRAP/FRB三元复合物插入到CAR结构中可以构成一个基于小分子的安全开关来控制CAR-T细胞活动 。
在雷帕霉素存在下 , 嵌合抗原受体执行抗原识别和信号传导功能 。在雷帕霉素不存在的情况下 , 抗原识别域与CAR结构的信号转导域分离 , 使CAR-T细胞处于“关闭”状态(图4) 。因此 , 雷帕霉素可用于远程调节CAR-T细胞的活动 , 以避免潜在的致命毒性作用 。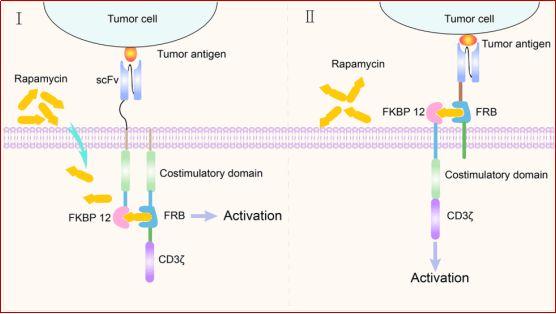
文章图片
文章图片
图4. 雷帕霉素作为分子开关的示意图
2.3 Rimiducid诱导Caspase-9二聚化并促进过度活化的CAR-T细胞凋亡
当CAR 结构包含编码自杀基因的融合蛋白时 , Rimiducid(AP1903)和更昔洛韦等CID可以诱导 CAR-T细胞凋亡 。使用Rimiducid和诱导型caspase-9组成安全开关 , 可以通过小分子诱导的细胞凋亡迅速终止CAR-T细胞的治疗活性(图5) 。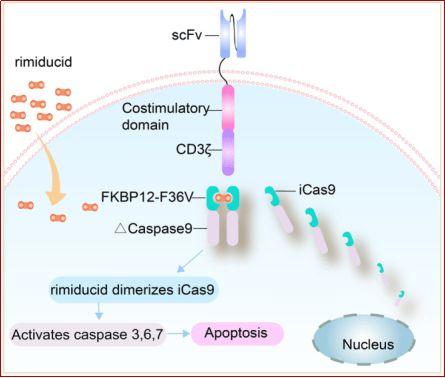
文章图片
文章图片
图5. iCas9系统诱导CAR-T细胞凋亡示意图 。
2.4 PROTAC技术控制CAR的裂解和降解
当CAR识别并结合靶肿瘤细胞表面相关肿瘤抗原 , CAR-T细胞即保持激活状态 。因此 , 可设计一种安全开关 , 通过精确控制CAR的降解来远程和可逆地调节CAR的表面呈现 , 以调节CAR-T细胞抗癌活性 , 并降低潜在毒性 。
目前 , PROTAC是降解细胞内特定蛋白质的最有效方法 。CAR是一种人工合成的蛋白质 , 通过将蛋白降解子(degrons)掺入CAR , 一旦蛋白降解子被蛋白水解酶识别 , 理论上降解整个CAR蛋白应该是可行的 。目前 , 多种新型小分子已被用于控制CAR 的降解(图6) 。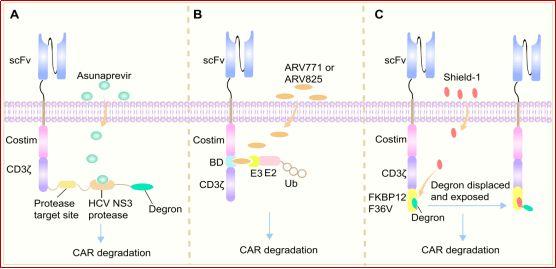
文章图片
文章图片
图 6. PROTAC技术通过泛素-蛋白酶体系统控制CAR降解的示意图
2.5 达沙替尼直接阻止CAR-T细胞激活
现有药物也可作为药理安全开关 , 暂时灭活CAR-T细胞以控制其毒性 。并且 , 停用安全开关药物后 , 抗肿瘤作用可恢复 。
达沙替尼是一种针对BCR-ABL和SRC的小分子多酪氨酸激酶抑制剂 , 通过抑制淋巴细胞特异性蛋白酪氨酸激酶(Lck)来抑制TCR介导的信号转导、细胞增殖、细胞因子产生和体内T细胞反应 。因此 , 达沙替尼可作为一种潜在的药理学安全开关药物 。但达沙替尼并非专门设计为小分子安全开关 , 将其称为CAR-T细胞的小分子安全开关还存在争议 。
3、总结:小分子CAR-T开关任重道远
目前对CAR-T细胞疗法的研究主要集中提高临床疗效、减轻抗原逃逸和增强CAR-T细胞的特异性等方面 。为了实现这些目标 , 在嵌合抗原受体构建体中引入了各种修饰 。目前 , 处于开发阶段的第四代CAR , 可以传递细胞因子或趋化因子 , 以产生对免疫抑制性肿瘤微环境的抵抗力 。此外 , 正在开发的双靶点和多靶点CAR可同时结合两种或多种肿瘤抗原 , 以提高对肿瘤细胞的特异性 。
推荐阅读
- uzi被骂事件突然反转,粉丝爆破之后,事件迎来了反转
- 王者荣耀本月25日将迎来王者荣耀新赛季,这三点原因已经公布
- 中国原研CD19 CAR-T创新药走向全球
- 跨越星海:八重神子大招越来越猛,黯色空壳却迎来削弱
- 预制菜市场迎来新玩家,钱大妈力推“短保预制菜”
- 王者荣耀周年限定皮肤终于迎来返场新老玩家面对限时皮肤该怎么选
- 我国运动康复供需不足,数字疗法探索传感器远程指导康复
- 动视暴雪被高溢价收购 坐拥大量游戏金矿的腾讯将迎来什么?
- 春节将至,你准备好迎来王者新“年限”了吗?
- 脑针快讯丨宫氏脑针疗法最新修定










