BMS首款TyK2抑制剂上市申请获FDA和EMA受理
作者:凯莱英医药
11月29日 , 百时美施贵宝(BMS)宣布 , FDA受理了首款TyK2抑制剂Deucravacitinib上市申请(NDA) , 此外 , 欧洲药监局(EMA)也受理了该药的市场营销授权(MAA) , 用于治疗成人中至重度斑块型银屑病 , FDA的PDUFA日期为2022年9月10日 。这是继Deucravacitinib治疗成人中度至重度斑块型银屑病、脓疱型银屑病和红皮病型银屑病上市申请在日本获受理后的最新监管里程碑事件 。如获批 , Deucravacitinib将成为首个获批上市的TyK2抑制剂 。

文章图片
文章图片
本次NDA和MAA申请基于两项随机、双盲、安慰剂和活性药物对照、平行分配的III期试验(NCT03624127 , POETYK-PSO-1;NCT03611751 , POETYK-PSO-2) , 两项试验评估了Deucravacitinib相较于安慰剂或阿普斯特(Apremilast , Otezla)对中度至重度斑块型银屑病患者的疗效和安全性 。Apremilast是由Amgen开发的PDE4抑制剂 , 于2014年获FDA批准上市 , 用于适合光疗和系统疗法的中度至重度斑块型银屑病(PlaquePsoriasis)成人患者的治疗 , 2020年阿普斯特全球销售额为21.95亿美元 。
【BMS首款TyK2抑制剂上市申请获FDA和EMA受理】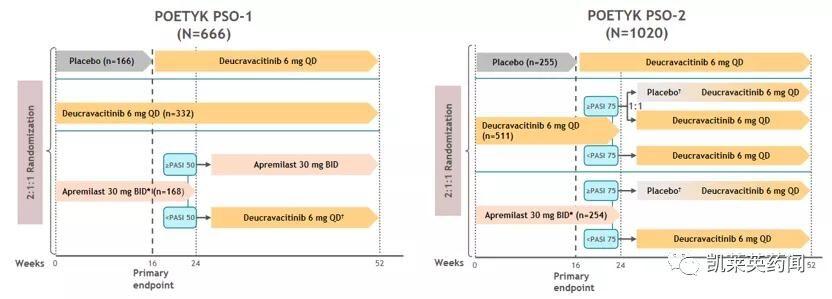
文章图片
文章图片
顶线试验数据显示 , 第16周时Deucravacitinib组PASI评分降低75%以上患者比例达58.7%和53.6% , 显著性高于Apremilast组(POETYK-PSO-1:P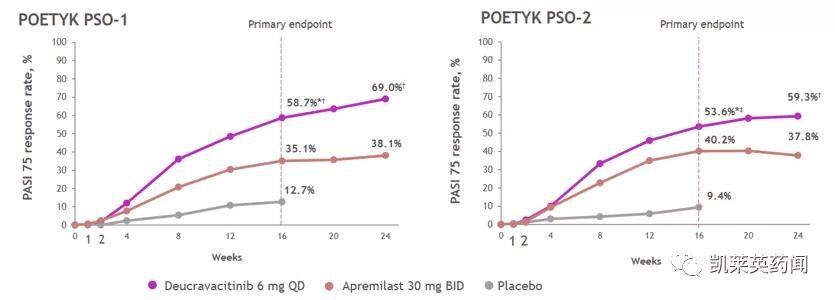
文章图片
文章图片
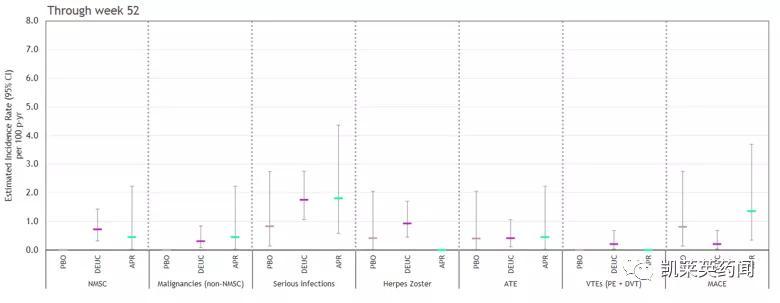
此外 , Deucravacitinib并未导致与JAK激酶1-3抑制相关的不良反应事件的出现 。
文章图片
文章图片
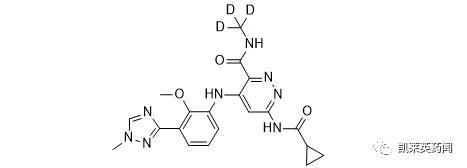
Deucravacitinib是由BMS开发的新型、口服、选择性酪氨酸激酶2(Tyrosine kinase 2 , TyK2)抑制剂 , 同时也是一款氘代药 , 其化学结构如下图所示 。
文章图片
文章图片
酪氨酸激酶2(Tyrosinekinase 2 , TyK2)是Janus激酶家族(JAK)的成员 , JAK家族包括四种酪氨酸激酶 , JAK 1、JAK2、JAK 3和TYK2 , 它们与I类和II类细胞因子受体超家族的细胞内结构域相关 。这些受体结合其细胞因子配体后 , 激活特定的JAK配对蛋白 , 激活磷酸化介导的信号转导和转录激活因子(STAT), 导致其调节驱动免疫细胞激活的基因表达 。因此 , JAK蛋白介导对IBD相关细胞因子的促炎反应 , 包括白细胞介素IL-6、IL-23、IL-13、IL-15和干扰素IFNγ等 。不同JAK激酶作用途径如下图所示 。
TyK2参与不同细胞因子(如I型IFN、IL-6、IL-12或IL-23)启动的细胞内信号传导 , 并导致下游的STAT磷酸化 。其中 , 其参与的IL-23信号通路在银屑病(Psoriasis , 见下图)相关炎症信号通路中发挥重要作用 。此外 , Tyk2基因变异与多种自身免疫性疾病有关 , TyK2的失活变异对包括系统性红斑狼疮(SLE)在内的多种免疫介导的疾病具有显著的保护作用 。

文章图片
文章图片

文章图片
文章图片
推荐阅读
- 和平精英:首款特效平底锅的实战效果!颜值在线,氪度却不美丽!
- 王者荣耀:杨玉环首款传说皮肤确认,和金蝉唐僧皮肤成情侣限定
- 网易首款开放世界来袭!欲进此界,必先自废武功?
- 王者荣耀:12月首款限定皮肤基本确定,狄仁杰两款新皮肤爆料
- 《御龙弑天》国内首款实现战斗双端同步的手游
- 奶茶届的天花板又拉高了!农夫山泉推出首款可可口味瓶装奶茶
- 王者荣耀:14号武圣返场先别急,关羽首款不骑马新史诗来袭
- 春节皮肤返场确定,高配版神秘商店突袭,杨玉环首款新传说上线必
- “人体补丁”或成现实,诺一迈尔研发全球首款皮肤修复“膏药”
- 对变异株有效吗?跟疫苗有何不同?……首款新冠药物解读来了







